小塚芳道/(株)真空デバイス
始めに
「マイクロテクニック」という言葉を何の疑いもなく日常的に使用してきましたが、英語辞書でその定義を調べてみると、通常の英語辞書には掲載されていないことがわかりました。これにより、自分が普段から使用してきた言葉が一般的な辞書に載っていないことに驚きを覚え、医学関連の用語を収録している辞書があることを思い出し、Dorland’s Illustrated Medical Dictionaryを開いて ”Microtechnique”を検索してみました。そうすると、見出し語が”Microtechnic Micrology”と記載されており、Micrology = ( micro + logos (ギリシャ語 = study )、顕微鏡観察に必要な取り扱いを研究する学問分野、とありました。
これは正にそのとおりで目に見えない微生物、動物 (人を含む)が対象で観察目的にしたがって細胞、組織を処理する呼び名全般が、マイクロテクニックの語源のようです。私自身が生物の形を観察し始めてからかなりの時間が経過しました。自分の眼による観察から拡大鏡、光学顕微鏡、透過型電子顕微鏡 ( TEM ), 走査型電子顕微鏡 (SEM) と、歳と共に装置は全て手動から半自動、全自動に変わりましたが、形態学の研究分野は年毎のように先細り状態で、将来このままでは形態学が無くなるかもしれないと言う話もあるのです。
原因は何でしょう?簡単な理由です、“形態学では生活出来ない”のです。悲しい事ですがこれが日本の生物学の現状なのです。日本に電子顕微鏡が導入された時期からこれまでの経過を考えると解決策が見えてくるかも知れません。日本の諺に“故きを温ねて新しきを知る。”と言うものがあります。詳細を記述するのが目的ではなくこれまでどのような方法で生物を顕微鏡レベルで観察したのか? を考えることに致しました。話が時として前後するかも知れませんがご容赦いただければ幸いです。
顕微鏡の発明と観察結果の歴史
いろいろな物を拡大して観察した物が何であるかを記録し始め、いろいろな生物の成立ちを理解しようとした方法論の変化と観察結果の解析から生物を考え始めた最初の報告の歴史は次のようになるでしょう。(主な物だけを取り出して見ました。最初にコルクの構造を観察し細胞( Cell )を定義したのを歴史の始めとして時間軸の関係を示しました。
| 西暦(年) | 主な出来事 | 時間軸(年) |
| 1665 | フック(Robert Hook )コルクの構造から“細胞“と命名 | 0 |
| 1812 | モーレンハウア(Mollen Hawer )植物組織の解離処理 (Macelation )により固体は細胞の集合である事を証明 | 144 |
| 1831 | ロバートブラウン(Robert Brown ) 植物表皮細胞で“仁“(Nucleoles )を確認。 | 166 |
| 1835~ 1846 | H.V.モール ( H.V. Mohr ) 花粉、ツノゴケの胞子、気孔の口辺細胞で細胞分裂の観察 | 170 |
| 1838 | シュライデン( Schkeudeb )細胞説Cell Theory | 173 |
| 1839 | シュワン ( Schwann )細胞説Cell Theory | 174 |
| 1856 | レイデイッヒ ( Reidig )細胞とは核を持つ原形質の塊 | 191 |
| 1857 | ウイルヒョウ(Virchow)細胞は細胞より生ずる。“ Omnis celula e Celula“ | 192 |
| 1870 | ストラスブルガー( Strasburger ) 核は核より生ずる。“ Omnis nucleus e ncleo “ | 205 |
ここまでが近代的なマイクロテクニックが実際に機能する前の非常に荒っぽい年表だと思いますが、かかった時間はフックのコルク観察から200年の時間が経過しています。動植物の組織を観察するために、いろいろな薬品が使用され現在の化学固定が検討され始めたのは、1843年フランスのデ – ジャルダン( Du Jardin ) が最初と言われています。以来急速に化学的な処理方法がテストされた記録があります。これは化学的に組織を処理する事でより良い顕微鏡像を得ようとした最初の試みだったのでしょう。
| 化学固定の種類 | 人物 | 西暦(年) |
| ショウコウ、硝酸銀 | ジャルダン(Du,jardin) | 1843 |
| オスミウム | バルエル(Baruell) | 1849 |
| カルミン(天然色素) | コオーン(Cohn) | 1843 |
| ヘマトキシリン(天然色素) | ボーマー(Boehmer) | 1865 |
これ等が基礎となり光学顕微鏡の組織標本作成技術はフリーハンドセクションに加えてミクロトームの発明により薄く均一な組織片の作成が可能となりました。現在私の手元にある資料には、水を含む固定液として発表されたもので600以上、非水系固定液と呼ばれる固定液を僅かですが加わると600~700種類前後あります。
組織を染色し可視化する方法は天然色素から化学的な合成色素、細胞化学を利用した染色法から始まり単染色、二重染色、三重染色などと名付けられた細胞内の組織を色で表現する方法まで改良され現代に受け継がれてきました。ここまでにかかった時間が200年ということになります。
1933年に発表された電子顕微鏡の応用は医学系の研究室が最初だったと聞いています。それは光学顕微鏡よりはるかに高い倍率と分解能が得られる事が
判っていたからでした。光学顕微鏡で観察できない細菌の細かい構造を初めて観察した人は恐らくこれこそが医学を支える手法と機材と考えたと思います。僕が電子顕微鏡の試料作成、装置の取り扱い、保守などの研修を受けたのは1965年だったと記憶していますからざっと60年前になります。この頃の試料作成技術は現在と基本的には同じと考えて良いと思いますが装置の多様性と性能には格段の差が有ります。
例えば全てマニュアルだった TEM, SEMの操作は次々と機械にとって代わり、始動 – 装置の調整 – 画像の取得 – 装置の停止操作以外で使用者が直接手を動かすのはグリッドを試料ホルダーに入れる事とホルダーを試料室に入れて内部を排気し鏡体内に入れ、ホルダーを戻すだけ、と成りました。問題は試料作成部分です、これはこれまでの光学顕微鏡の方法がテストされたのは言うまでもありません。確かに新しい試料作製法が違えば見えなかった何かが観察出来る可能性が高いと考えた為か次々と新しい試料作成法が発表されました。不思議な事に新しい画像が発表され議論されたのですが、それが実用化される前に次の新しい方法が発表され、大半が新しい方法に手を染め方法が確立する以前に次を求めるといった事が繰り返されてきました。
短命だった色々な方法を挙げてみると
- 電子顕微鏡版のオートラジオグラフィー
- 酵素組織化学
- 免疫化学的な方法
- 凍結割断包(Freeze Fracture, Etching)
- 組織の急速凍結乾燥法
- 組織の急速凍結置換法
- 組織の加圧急速凍結法
- 凍結切片作成法
- 急速凍結法(液体窒素、液相プロパン、液体ヘリウムが冷媒)
- マイクロウェーブ固定法
- X-線分析法(非分散型)
- エネルギーロス分析法(EELS)
- 高角度傾斜ホルダーによるトモグラフィー
少なくとも上記13の試料作成技術は短い寿命の試料作成技術として活用された経験がある物です。装置は使用しないままのところが多く残念な事です。
結局200年の歴史を持つ従来のマイクロテクニックが電子顕微鏡(TEM)用に改良されて使用されています。これまで使用されたオスミウムに注目したのは良い結果を与えた試薬の一つでした。ではTEMの試料作成に要求される特性とはどんな物かを考えると多くの疑問があります。試料作成の技術指導書には組織は限りなく生きた状態に近く保存するのが望ましく生物の生活している状態に近い条件を満たすよう配慮する、と書かれております。しかし指針は?
- 試料の大きさは2x2 mm程度の大きさとする。
- 試料を取り出し直ちに4℃に冷却した等張乾燥液に入れる。
- 等張液の調整は蔗糖を添加して行う。
- 中性の緩衝液を用意しpHは中性に合わせる。
- 組織は安全カミソリの刃を半分に折り更に一部を折った刃の尖った部分を使って組織を細切する。
- ピペット等を使用して組織片を予め4℃に冷却しておいた固定液中に入れて組織を固定する。
この指針には多くの矛盾点が潜んでいるように思えてなりません。僕自身はこの指針を無視してからかなりの時間が経ちますが固定の問題はありません。
従来の固定条件
生きている状態と表現されていますがどんな状態でしょう?我々には生きている状態を表現する事は非常に困難な事です。実験動物の場合、ケージから取り出された状態で動物は掴まれているという異常な状態であるために正常に生きている場合とは言えないと思います。
全ての生物の生息場所が常に中性の環境にある事は無いはずです。例えば北海道釧路原野の植物はかなり塩濃度が高い環境だと思いますしサロベツ原野の動植物は泥炭地の中のpHがかなり低い所に生育しています。高山の乾燥地や海産生物など、これらを全て同じpHに調整した固定液で固定することに疑問を持ち、自然界で生きる動植物を固定する場合は、蒸留水または動植物の生育環境の水を使用して固定用の試薬を稀釈し、固定を行っていますが、これまでに問題はありませんでした。
温度に関しても生物の生息温度に合わせるべきと考えています。例えば温泉はかなり温度が高いのですが、その中にも生物はいます。温泉中に棲息する高温菌を直接4℃に冷却した固定剤に入れる事には抵抗があります。固定温度を管理する必要はないと思います。固定剤により既に生物組織は安定化されているからです。
良い固定法、固定液とはどんなものか?と問われた場合恐らく僕は“異なる固定液の効果は同じではないため、例えばオスミウムでのみ固定された切片から得られる画像は、その生物が固定された時点の状態を示しているため、おなじ組織をアルデヒドとオスミウムで固定した場合の組織像と比べることはできない”と答えるでしょう。
現在手元にあるのは電子顕微鏡用の固定液処方77、緩衝液26、包埋用樹脂29 が収録されていますが、実際に常用しているものは僅かです。燐酸緩衝液を使用し肝臓組織を処理しウラン、鉛の二重染色をするとグリコーゲンは写真濃度が高く表現されますが、カコジル酸緩衝液ではグリコーゲンはその位置に穴があるように表現されます。S-コリジン緩衝液では像のコントラストが高いとされる理由は、他の緩衝液と比較して、固定できなかった細胞成分がその後の処理過程で溶出するためと報告されています。
ミトコンドリアを例に考察
それではここからはミトコンドリアを一つの例として示しながら考察してみたいと思います。
以下に深海の条件(4℃、高圧、暗黒)で固定した微生物の画像を示します。
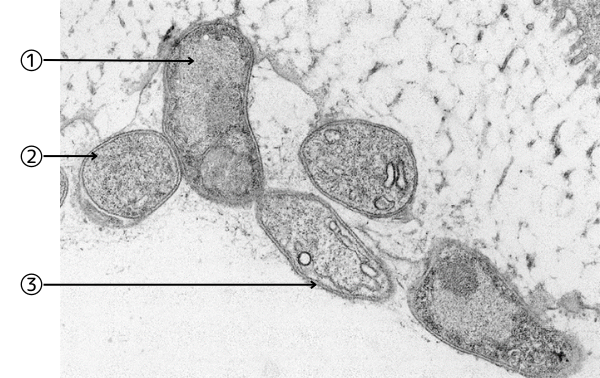
Fig-1
①膜に取り囲まれた細胞内には核(核膜、核小体を持つ)その下側にミトコンドリア(?)を持つ。
②細胞内に膜系がありそうだが膜そのものは不明。
③細胞内に僅かな小胞らしき膜構造を持つ断面。
Fig-2
二種のバクテリア間の共生
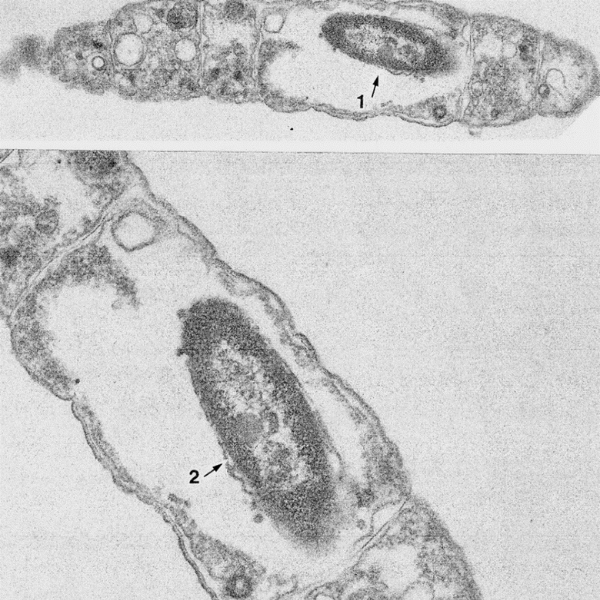
共生が見付かりました、細胞内の細胞は細胞壁が無い事からグラム(-)の可能性があります。ミトコンドリアか共生細菌でしょうか?
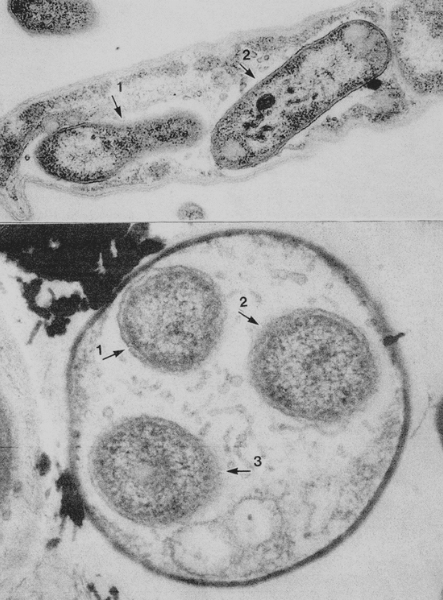
1、個々の細胞の外側は細胞壁、細胞膜に囲まれ内側にはリボソームと思われる顆粒があり核、ミトコンドリア様の構造物があるがいずれも完全に閉鎖された膜を持たず連続膜とは言い切れない構造を持っていた。
2、細胞壁は通常のグラムネガティブの原核生物に類似しているが、核膜に類似した構造があるため、この生物はバクテリアの範疇に入らず、原生生物である可能性がある。
3、有る細胞には別の核膜を持たない別の微生物が入り込んで居るものがある。
4、一つの細胞に共生している細胞数は複数の場合があり形の上で全く同じとは断定できない
共生関係を示す画像ですが、2個の微生物の場合同じ種であるのか同一種であるかは不明です。3個の微生物の断面から同じ物か、あるいは2個の共生バクテリアが分裂
して3個になったか不明です。共生細菌数は5個まで見つかっています。
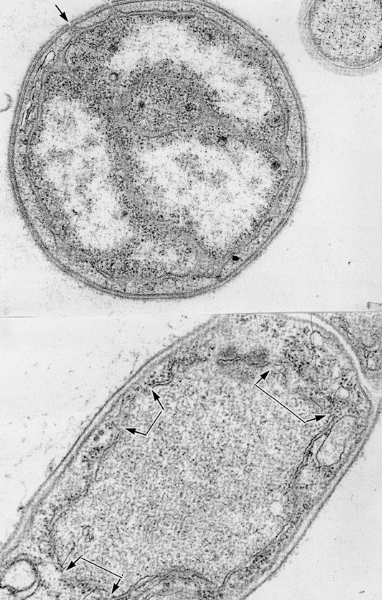
ここに示した画像は核膜と細胞膜が繋がっている状態を示しています。核膜を持つ細胞の核膜は明らかに核穴よりはるかに広いギャップを持ち不連続である事を示しています。
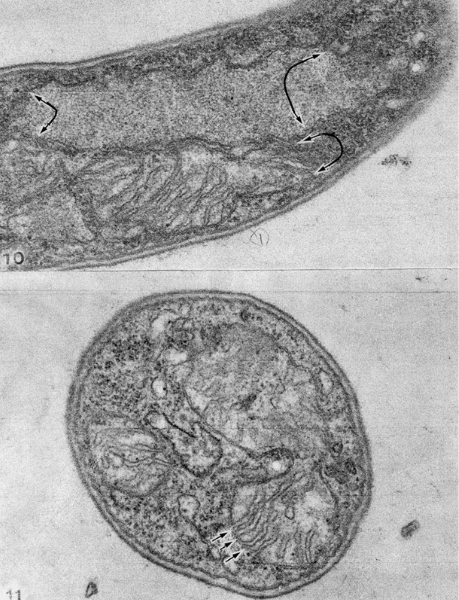
Fig.7
Fig.6と同じような核膜に不連続のある細胞とミトコンドリアに類似する膜構造がありますが外膜も核膜と同様に不連続です。深海の微生物の中には核膜が不連続、ミトコンドリアの外膜もクリステも不完全な膜系の真核生物と原核生物の中間形の生物が生息している可能性を示唆しています。
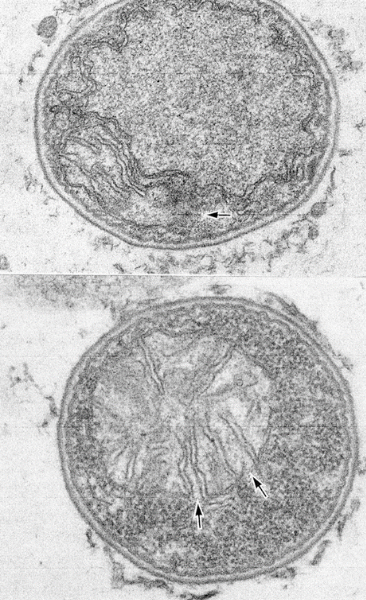
ここに示した二枚の画像は低倍率では見えないミトコンドリアの膜の不連続性を示しています。これまで示した核膜、ミトコンドリアの膜が何れも細胞膜の内膜が細胞内に接している事から細胞内の膜構造は既存の膜に由来すると考えると理解し易いと考えています。
ミトコンドリアが出来る過程は微生物間の共生関係が重要な役割をしたと考えられていますが、共生関係は一つのホストに入り込む外部からの微生物が確実に一個しかない場合に限られる場合の説明であれば理解できます。しかし今回の深海微生物には最大5個までの共生細胞が見付かっています。複数の共生細胞がある場合は次のような可能性が考えられます。
- ホストの細胞が複数の中の一つを選択する。
- 複数の共生細胞間の競争により選択される。
- 複数に見える断面から実は一つ又は複数の共生細胞の分裂により見かけの複数細胞の断面として表現されている。
- 現在の外部からの微生物の共生によるミトコンドリアの起源説はそれを示す画像は発表されていない。
これまで色々な細胞内の小器官の起源の中で最初は“細胞は細胞より生ずる。”と言われ、次いで“核は核より生ずる。”と言われて来ました。ミトコンドリアの場合の細胞内の膜系の生成を見ると、細胞膜の内側が細胞質内に延び始め核膜を作り、ミトコンドリアの膜を作ると考えると色々な事が無理なく説明する事が可能と思われます。これは細胞内の小器官は細胞膜から分化する、言い換えれば核膜やミトコンドリアなどの起源を無理なく説明する事が可能かもしれません。現実に核膜が核孔を持ち内部に核小体と核を持つ完全な形態に限りなく近い組織が単細胞の微生物で起っている事は事実と言えます。この問題はまだ完全に解析してはいないけれど原核生物と真核生物の中間的な構造を持つ微生物が存在する事を示唆している。これからの発展に期待したいと思います。
光学顕微鏡のマイクロテクニックの200年の歴史は非常な重さをもっており僅か100年に満たない電子顕微鏡のマイクロテクニックは未だ始まったばかりと考えなくてはなりません。特に試料作成の全ての過程を今一度考え直し新たな方法論を作る努力が必要な時期と考え、小さな改良も多く纏まれば新しい形態学の成長に何らかの貢献が出来る物と信じています。新しい電子顕微鏡用の組織を処理する場合は少なくとも3-4種類の異なった固定液を使用しその結果から最も目的に合った固定液を選択する事が必要でこの種のデータが蓄積される事でより好ましい組織の保存法を確立する事に貢献する事でしょう。唯一このような基礎的な実験には時間が必要であるため論文の数を稼ごうとする場合は手を出さない事です。否定的な事を言う前に形態学の奥の深さと新しい形の持つ美しさを体験する機会を作る事も必要でしょう。
略歴
| 生年月日 | 1933年(昭和08年)10月10日 |
| 学 歴 | 1956 静岡大学文理学部生物学科卒 1958年 北海道大学理学部大学院植物学科修士課程卒業 理学修士 1966年 北海道大学理学部大学院植物学科博士課程終了 理学博士 |
| 職 歴 | 1951年 テネシー州ヴァンダービルト大学生物学科 研究員。 1953年 テネシー州ヴァンダービルト大学生物学科 講師 1966年~1981年 千葉大学生物活性研究所 助手 1976年2月~1981年2月 コスタリカ大学電子顕微鏡センター創設プロジェクト JICA 医療部専門家 1981年8月~1981年10月 JICA 国際研修プログラム電子顕微鏡学第一回 開校式、研修講師 1982年1月~1982年3月 第一回国際研修 研修講師 1982年5月~1985年5月 JICA 医療協力プロジェクト フイリピンマニラ 熱帯医学研究所 JICA 医療部専門家 電子顕微鏡応用技術移転 1986年5月~1989年4月 バイオテクノロジー研究支援、コスタリカ大学細胞, 分子生物学センター 1990年3月~1993年11月 在東京カナダ大使館科学技術室 調査官 1993年12月 JICA 国際研修プログラム電子顕微鏡学 研修講師 1994年1月~4月 JICA 医療専門家、コスタリカ医療協力アフターケア真菌症研究、調査。 1994年6月~1996年6月 JICA 専門家、コスタリカ大学電子顕微鏡センター 1996年10月~1996年11月 JICA 専門家、コスタリカ大学 国際研修電子顕微鏡学講師 1996年11月~1996年12月 JICA 調査官 中南米9カ国対照 国際電子顕微鏡学研修プロジェクト1981-1996年総合評価調査団 1998年8月 国立神経、精神センター神経研究所微細構造研究部 研究員 1998年11月~2002年3月 東京電力中央研究所界面活性研究部 研究員 北里大学医療衛生学部 非常勤講師 東京医科大学神経生理学講座 兼任講師の後 2011年5月~ 株式会社真空デバイス技術顧問 現在に至る |









