ここでは、t-ブチルアルコール100%に置換したサンプルを、電子顕微鏡で観察できる状態、そして観察までを解説しております。
試料作製の流れ
試料作製の工程は、大まかには以下のような流れとなっております。
- 採取:観察対象となるサンプルを採取します。今回は身近なもので、シクラメンの葉を使います。
- 前固定:単固定、二重固定。固定とは新鮮な組織を化学的に処理することで出来るだけ生きた状態に近く安定化し、乾燥処理の間に組織がひずまないような処理を行うことです。
- 固定液の洗浄:単固定、二重固定ともに、最初に使用された固定液を洗い流す作業です。
- 後固定:固定液を使用し、二回目の固定を行う作業です。
- 洗浄:後固定で使用した溶液を洗い流す作業です。
- 脱水:濃度の異なるエタノールを用意し、段階的にエタノール置換を行う作業です。
- 置換:100%エタノールから100%t-ブチルアルコールへ置換を行う作業です。
- 凍結乾燥:サンプルを乾燥状態にする工程です。
- 載台:出来上がった乾燥試料をSEMの試料台に載せます。
- コーティング:導電性のない試料にメタルコーティングを施します。
- SEM観察:長い工程を経て作成されたサンプルを観察します。
このページでは、凍結乾燥からSEM観察までを解説します。
作業前の予備知識
凍結乾燥法に利用する装置は2種類ございます。
一昔前は臨界点乾燥法が主流でしたが、高圧のガスを使うことなどから導入が大変で、現在は安全で手軽なt-ブタノール凍結乾燥装置が広く利用されております。ふたつの違いについて簡単にご説明いたします。
t-ブタノール凍結乾燥法(t-BuOH FD)とは
生物試料など水分を多量に含む試料はそのまま乾燥すると収縮や変形を起こします。特に軟組織では十分固定した試料でも水の表面張力で微細構造が大きく変形します。この変形を防止するため試料を固定、脱水した後t-ブタノールに置換し、冷却して凍結し、固体状態にした後真空中でt-ブタノールを昇華させることにより試料の原形を保ったまま乾燥させるのがt-ブタノール凍結乾燥法です。
臨界点乾燥法(CPD)とは
CPDは液体炭酸を利用します。液体炭酸は室温で60気圧以上の圧力を持ち、さらに液体と気体の共存する臨界温度では100気圧以上になります。この高い圧力の中で試料の溶媒を液体炭酸の中に溶け出させた後、溶媒を含む炭酸ガスを大気中に放出して試料を乾燥させます。即ち、CPDは極めて高い圧力の中で乾燥する方法です。
臨界点乾燥法と凍結乾燥法の注意点の違い
CPDもt-ブタノール凍結乾燥も固定から脱水までの行程は全く同じです。CPDの場合は脱水を完全に行う必要があり、脱水の最終工程は100%のエタノ-ル、あるいは酢酸イソアミルに置換しますが、水分が僅かでも残っていると炭酸ガスは水分を残したまま排出され、残された水分が試料を変形させます。高圧下では水分が蒸発しないためです。
t-ブタノール凍結乾燥の脱水の最終工程はそれほど厳密では有りません。それはt-ブタノール自身が極めて吸湿し易く100%で存在しにくいためです。市販の特級品でも0.5%程度の水分を含んでいます。従って脱水は95%エタノ-ルの程度まで行い、最終工程は100%(実際は99.5%程度)のt-ブタノールで2回程置換すれば十分です。しかしt-ブタノールは浸透力が弱いので最終工程では35~45℃の温度に30~60分間保持し、試料内に十分t-ブタノールを浸透させることが良い結果を得る秘訣になります。僅かに含まれる程度の水分は真空排気によりt-ブタノールと共に昇華してしまいます。
乾燥後、大気に戻すための注意はどちらも同じです。乾燥終了時の圧力は、CPDの場合100気圧以上、凍結乾燥法の場合で数Paです。急激に大気に戻すとCPDでは試料が膨張して破れ、凍結乾燥法では圧縮されて変形します。そのためCPDでは1時間ほどの時間をかけてゆっくり大気圧に戻します。
凍結乾燥法の場合は圧力差が小さいので2~5分かけて空気を注入し、大気圧に戻します。
必要な器具・試薬類
器具類
導電コーティング装置(スパッタ装置又はオスミウムコーター)
- 実体顕微鏡
- SEM試料台
- カーボンテープ
- 銀ペースト
- 竹串
- ピンセット
試薬・消耗品
- t-ブチルアルコール
試料カップへサンプルを移し凍結乾燥装置に入れる
サンプルを専用のアルミカップへ移します。観察したいところをピンセットで潰してしまわないように注意してください。カップにはあらかじめ識別用のNoなどを記入しておくと良いでしょう。
アルミカップは付属品以外でも形状の制約は特にございません。試料ステージに載る大きさで金属製(アルミ又は銅)のものが良いでしょう。ガラスの容器は熱伝導性が悪く、サンプルの内部まで十分に凍結されないことも考えられますのでお勧めは出来ません。熱伝導性を考慮して容器を選定してください。
t-ブタノールは大変吸湿しやすいので、試料ステージの冷却までを素早く行ってください。
カップに試料を移しましたら、サンプルが浸る程度に、100%t-ブタノールを注ぎます。
※t-ブタノールは必要最小量で結構です。過剰に多い量を入れると無駄になる上に昇華にとても時間が掛かってしまいます。装置の試料台に素早く載せ、上蓋を閉じてください。
凍結乾燥装置
凍結乾燥のプロセスは以下の通りです。
① 試料ステージを冷却しt-ブタノールを凍結させる。
② 完全に凍結した状態で真空排気を行う。
③ 凍結したt-ブタノールが気体となって昇華する。
④ 完全に昇華しt-ブタノールが無くなったら試料ステージを温める。
⑤ サンプルが常温に戻ったら取り出す。
これら一連の工程を、凍結乾燥装置で行います。
VFD-30型凍結乾燥装置はこれらの工程を全自動で行うことが出来る優れものです。
凍結
t-ブタノールは表示温度が20℃を下回ると凍結をし始めます。
表示温度が10℃を下回るころには凍結し、白く結晶状に変化します。
乾燥
十分に凍結された状態で、真空排気をONします。凍結したt-ブタノールが液体に戻らず、直接気体となって昇華します。見た目にも徐々にt-ブタノールの結晶が減少していく様子が確認出来ます。
完全に結晶が無くなったら完了です。
稀に、白い綿のようなものが残り、一向に無くならない状態に遭遇することもあるようです。これは、t-ブタノールの結晶ではなく汚れや溶出物などが残ったものになります。置換の作業が不十分であったり、使用している道具が汚れていると起こりやすいです。プラスチック製のピペットは離型剤などが溶出する場合もあります。清潔なバイアル瓶や試料カップ、ガラス製のピペットなどがおすすめです。
加温
乾燥工程ではまだ、試料ステージは冷却されています。この状態で試料を取り出すと、大気中の水分が付着し結露してしまいます。せっかく乾燥させたサンプルが結露した水分で変形してしまうので、試料を取り出す前に室温より少し暖かい程度に加温します(30℃程度)。
試料が温まったら大気リークを行ってサンプルを取り出します。
サンプルの選定
観察したいサンプルを、実体顕微鏡を使って確認致します。ピンセットで掴む際に、観察したい場所をつぶしてしまわないように注意します。
載台
載台のポイントは、観察したい場所を正面に配置し、観察結果を想像しながらセッティングをします。
そして、導電コーティングをした際に導通が取れるように配慮してください。
銀ペーストを利用する場合は、必要最小量としてください。十分に乾燥させる必要があり、真空中でガスが出やすいため、大量に使用すると失敗の原因にもなり得ます。

導電コーティング
導電コーティングに使用する装置は、観察倍率やサンプルの構造によって使い分けると良いです。
観察倍率が数百倍~数千倍程度であれば金、1万倍~3万倍程度であれば白金、それ以上の倍率であったり、サンプル構造が複雑な構造をもっているのならばオスミウムコーターを利用するのが一般的です。
今回は弊社で販売しておりますオスミウムコーターHPC-20を使ってコーティング致します。全自動なので、セットすればあとは別の作業が出来て簡単です。
SEM観察
ここまでに様々な処理を行ってきたわけですが、最終的なサンプルの出来栄えは観察してはじめて分かります。
処方を変えた結果を最後に示します。
補足説明
ここまで、一連の処理の流れを解説してまいりました。そして化学固定のプロトコルはごく一般的な処方に基づいて行いました。しかしながらここで理解しなければならないことは、プロトコルは一つではないということです。
固定液の濃度を変えたり、固定液の種類を変えることでも観察結果が変わってきますので、まずは教わった方法を試し、次にそのサンプルの構造や環境を考慮した処方を順次試して比較してください。
正解が一つということではなく、処方を変えた結果が違うということを理解し、ベストな処方を探していくことです。そのような工夫と追及が新たな発見に繋がっていくことだと思います。
処方を変えた例(シクラメン)
前固定(Buffered4%GA + 2%PF) + 後固定(Buffered1%Os)
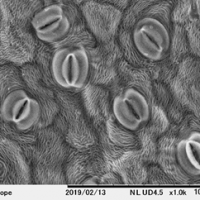
前固定(Unbuffered4%PF)
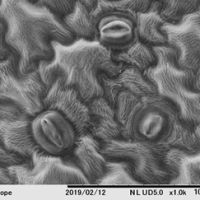
前固定(Unbuffered4%PF) + 後固定(Unbuffered1%Os)
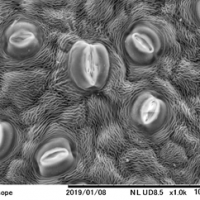
このように前処理の処方が違うだけでも見え方に差が出てまいります。生物はその生育環境に適した特徴を有しています。「固定」の世界はとても奥が深く、さまざまな処方が試されてきた歴史があります。
いつか「固定」についてのアーカイブがまとめられるよう頑張ってみます。
先生、生物試料の作成からSEM観察まで解説をありがとうございました。
最初に出くわした結果がすべてではないといっても過言ではありません。
私たちは探求を続ける研究者の良い脇役となれるよう装置開発に励んでいきます!



今ここ

記事監修![]()








